| 植物生態学研究室のメンバーのページへ |
| English version, here |
寺島 一郎の研究紹介 |
| これまでに僕が行って来た研究を解説します。現在,研究室に所属するメンバーが盛んに研究している分野は,解説を省略しましたので,それぞれの担当者のページをご覧下さい(10年ぶりに改訂しました!2013年4月10日)。 |
| (1) 葉の内部の光環境と葉の光合成の関係 |
| (2) 葉および個体の光合成における窒素利用と老化 |
| (3) 光阻害 |
| (4) 葉の光合成におけるCO2拡散,CO2拡散におけるアクアポリンの役割 |
| (5) 高山植物の光合成 |
| (6) 樹木の光合成系の構築過程 |
| (7) 学位論文の研究など |
| 略歴 |
(1)葉の内部の光環境と葉の光合成の関係(1982〜現在) |
| 葉は表側に多くの光を受けるので,葉の内部には葉の表面が明るく,裏側に行くほど暗くなるという環境勾配があるはずだが,定量的にどの程度暗くなるのかは明らかではなかった。そこで,「門司・佐伯」の群落光合成の研究(原著はドイツ語,Dr. Marcus Schortemeyer による英訳 ”On the Factor Light in Plant Communities and its Importance for Matter Production” がAnn. Bot. 95:549-567 (2005) にある。)に用いられた層別刈り取り法を応用して,ヤブツバキの葉を表皮に平行に切った切片(並皮切片)を得て,葉の組織の光学的な性質を調べたその結果,同量の色素を含む柵状組織と海綿状組織を比較すると,海綿状組織の方が光を吸収しやすいことがわかった。逆に,光の強い柵状組織は,光を過度には吸収しない。この違いは,主として細胞の形態による光散乱の度合の違いに依存している。海綿状組織では光が組織内を行ったり来たりするうちに葉緑体に遭遇し,吸収されるのである。組織による光学的性質の違いは,葉の内部の葉緑体の光吸収に,過度な違い差がないようにすることに役立っている(1-1)。 |

|
| 図1 門司先生(左)と佐伯先生(右)1970年頃 門司正三先生と佐伯敏郎先生(僕の指導教官)の写真。佐伯先生は,数学科に行こうか植物学にしようかと迷ったほどで,数学が大変よくできる鋭い先生だった。しかし,夜になると・・・(以下,寺島の履歴参照)。 |
| 一枚の葉の内部の葉緑体の光吸収には柵状組織と海綿状組織の分化によって,過度の差が生じないようになっているが,それでも,葉の内部の明るい場所に位置する柵状組織の葉緑体は海綿状組織の葉緑体に比較して,単位色素あたりの光吸収量は多い。このような環境勾配の存在する葉の内部では葉緑体の性質も不均一なのではなかろうか。こう考えて,ヤブツバキの葉の並皮切片から葉緑体を単離してその性質を調べたところ,柵状組織の葉緑体は陽葉タイプの,海綿状組織の葉緑体は陰葉タイプの葉緑体を持っていた(1-2)光合成の研究によく用いられるホウレンソウで詳しい解析を行ったところ,単位クロロフィルあたりの反応中心の含量は柵状組織葉緑体が高かった。また,電子伝達系構成要素,RubisCOなどの含量も柵状組織葉緑体が高かった(1-3)。葉を10枚に「おろした」切片から葉緑体を単離してその性質を比較したところ,葉緑体の性質の違いは,柵状組織と海面状組織で二分的ではなく,連続的であった (1-4, 図2)。また,陰葉タイプの葉緑体はグラナにおけるチラコイドの枚数が多いという性質は,葉の内部でも認められた(図3)。葉の展開中に葉の裏側から光をあてたままにしておくと,グラナあたりのチラコイド膜の枚数の勾配も逆転した(1-5)。 |
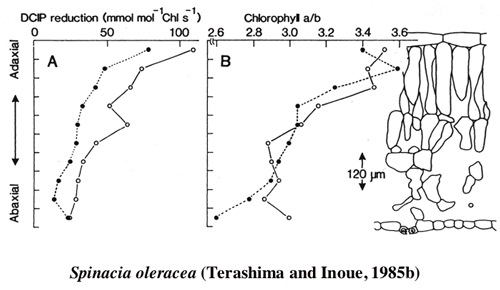 |
| 図2 ホウレンソウの葉を10枚におろした切片から得た葉緑体の性質 表側の葉緑体はクロロフィルa/b比が高く,クロロフィルあたりの光合成活性も高い。このように一枚の葉の内部の葉緑体も陽葉緑体−陰葉緑体の勾配が見られる。 |
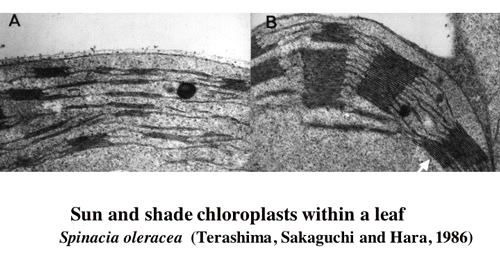 |
| 図3ホウレンソウの一枚の葉の表側(柵状組織第一層)の葉緑体と裏側(海綿状組織)の葉緑体グラナあたりのチラコイド膜の層数に大きな違いがある。 |
| 葉の内部の光吸収パタン(海綿状組織の方が光を吸収しやすい)と、葉の内部の陽葉緑体-陰葉緑体勾配の存在が、葉の光合成に及ぼす影響を簡単なモデルを用いて解析した。どちらも、葉の光-光合成曲線の直線的フェーズから飽和フェーズへの遷移を速やかにし、光の利用効率を高める性質があることを示した(1-6,図4)。 |
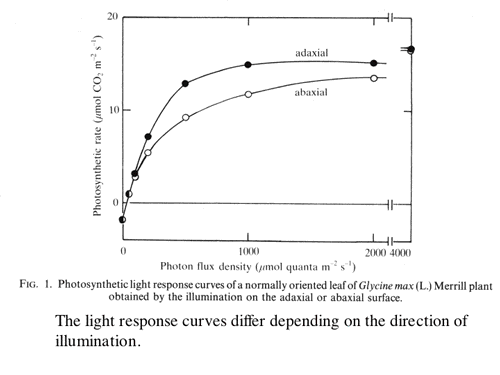 |
| 図4 同じ葉に表側から光を照射した方が,光−光合成曲線がシャープになる。光資源が有効に使われている。この現象は僕が発見したわけではない。Oja and Laisk (1976) Soviet Plant Physiology, 23: 381-386. がすでに報告し理論的に解析していた現象である。僕のやった葉の内部の解析により,Oja and Laiskの予想が実証されたことになる。ただ,生態学的な資源利用の観点からの議論は僕が最初。あんまり偉くもないか。 |
| 葉に表から光を照射した場合と,裏側から照射した場合とでは,葉の光-光合成曲線が異なるこのことを確認し,両側から光を照射した効果などを考察した(1-7)。
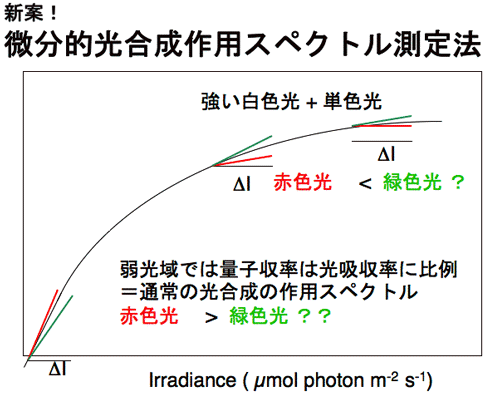
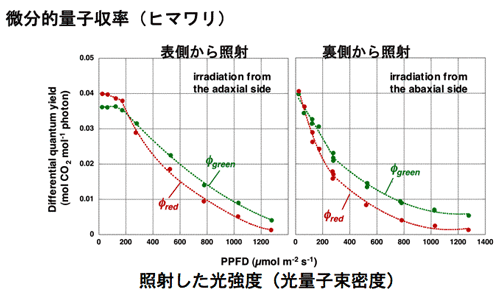
1986年に修士論文,博士論文としてのこれらの一連の仕事を終えた。これらの研究は案外評判もよく,Vogelmann,Nishio,Evansら,いろいろな人が研究を発展させた。その一つの成果に,葉の内部にみられる光吸収の勾配と,葉緑体の光合成活性の勾配は一致していないことがある。これらの勾配を比較すると,光吸収の勾配の方が急峻である。おそらく,葉緑体の光馴化の巾がそれほど広い光環境には対応できないためであろう。 勾配が一致しないのならば,葉の表側から光を照射して光合成を行わせると,表面近くの葉緑体の方が裏側近くの葉緑体よりも弱い照射光で光飽和に達するはずである。さらに光を強くする場合に,クロロフィルがよく吸収する赤色光や青色光を与えても,これらは,すでに光飽和した葉緑体に吸収されるので熱として散逸される可能性が高い。しかし,緑色はあまり吸収されないからこそ,葉の奥深くまで到達し,海綿状組織内を何度も行き来することにより葉緑体に何度も遭遇するのでかなり吸収される。葉の奥深くの葉緑体は,まだ光飽和に達していないので,こうして吸収された緑色光は光合成を駆動するのではないか?と,考えた。 通常,光合成に何色の光が有効かを判断する場合には,作用スペクトルを作成する。この場合,葉に弱い単色光を照射して光合成速度を測定するのが常道である。しかし,これでは強光下でどの色の光が役立つのかを調べることはできない。そこで微分的作用スペクトルの作成方法を考案した(図5)。ある一定の光強度の白色光に単色光を足して,光合成速度の増分を測定するのである(微分的作用スペクトル測定法,図参照)。この増分を加えた単色光の光量子束密度(光の強さ)で割ると,ある強さの白色光下で単色光の微分的量子収率を求めることができる。この方法を用いて赤色光と緑色光の微分的量子収率を測定すると,ごく弱光では,葉全体でよく吸収される赤色の微分的量子収率が高いが,やや強い光の下では,奥深くまで到達する緑色光の方が,微分的量子収率が高くなる。強光下では,赤色光よりも緑色光の方が光合成に役立っているのである(図6)。 |
|
| 図5 微分的量子収率測定法 一定の光量子束密度の白色光に,単色光を足して,単色光による光合成速度の増分を単色光の光量子束密度で除して微分的量子収率を求める。 |
|
| 図6微分的量子収率測定法によって求めた,白色光中の赤色単色光と緑色単色光の微分的量子収率。低光量子束密度の時には,吸収率の違いを反映して赤色光の微分的量子収率の方が大きいが,高光量子束密度では緑色光の方が光合成を有効に駆動する。材料はヒマワリ(Terashima et al. 2009)。裏側から光を照射すると海綿状組織にあたるため、光が表側に到達しにくい。このため、緑色光が弱光域から有利になる。 |
| 「葉は緑色に見えるこれは葉が緑色を光合成に使っていないからである」という説は二重の意味で間違っている。緑葉はかなり緑色光を吸収することができるし,いったん吸収された緑色光は光合成を駆動する。こればかりではなく,強光下では緑色光の方が赤色光よりも光合成を高効率で駆動しているのである(1-9)。なお,葉の内部の光環境と光阻害との関係は,ポスドクとして在籍した小口理一さん(現 東北大生命科学研究科助教)が詳しく解析してくれた(1-10)。葉の表側と裏側の気孔の光応答については,大学院生だったWang Yinさん(現 名古屋大学WPI助教)が詳細に検討した。気孔の光応答の栽培光環境への馴化応答を明確に示した。また,葉の裏側の気孔は緑色光で開孔することを初めて報告した(1-8, 1-11)。D3の河野優君が、変動光環境への光合成系電子伝達系の馴化について研究している。 |
原著論文 |
総説
|
(2)葉および個体の光合成における窒素利用と老化(1987〜現在) |
| 富栄養条件で植物を栽培すると,葉の面積あたりの窒素含量は上昇し,葉面積あたりの光合成速度も上昇する。一方,強光下で植物を育てた植物の葉(陽葉)の光合成速度は,弱光下で育てた葉(陰葉)の光合成速度よりも大きい。富栄養,強光,両者に光合成速度を高くするという共通点はあるが,栄養と光の効果に違いはないのだろうかホウレンソウを3段階の光環境,4段階の窒素栄養条件下で栽培して,葉および葉緑体の光合成の性質を比較した明るい光環 境・富栄養条件下で栽培すると,葉面積当たりの窒素含量は増加するが,それと同時に,光合成系の構成要素間の窒素の分配も異なり,たとえば,クロロフィルあたりのRubisCO量は明るい方が多い暗い光環境では光吸収を大きくし,明るい光環境では光飽和光合成速度を大きくするように窒素が分配されることが明らかになった(2-1,2-2)
彦坂幸毅さん(現 東北大学生命科学研究科)は,光合成器官内の窒素分配の問題をさらに詳細に解析した,葉緑体内の窒素を5つのグループに分類し,最適窒素分配の理論的なモデルを構築した(2-3)また,草本植物(2-4)および木本植物(2-5)を使ってモデルを検証した 一般に植物群落では,群落上部は明るく下部は暗いという光環境の勾配がある当初は陽葉として発達した葉もやがて若い上位葉に覆われることになるこの時,古い葉のタンパク質は分解され若い葉に転流されるこの窒素再分配を支配する要因として,葉の老化と光環境のどちらが重要かという問題を解決するために彦坂幸毅さんは,つる植物を使ったシステムを構築し,窒素栄養が十分あれば,光環境が重要な要因となることを示した(2-6)。また,古い葉の老化過程は,若い葉に被陰されておこる積極的な陰葉化の側面をもつことを実証した(Hikosaka, K. [1996] Planta 198:144-150)。 個体内部で葉が自身の光合成に関する地位をどのようなメカニズムで感じているのかを明らかにするのは研究室の大きなテーマである。葉が生産した光合成産物に対する需要が大きく盛んに転流される場合には,葉の炭水化物含量は少なく,そうでない場合には多くなることから,「sugar- repressionが,葉が個体内部の光合成的な地位を感じるメカニズムとして重要である」という仮説を検証してきた。PDの小野清美さん(現 北大低温研助教)は葉の老化過程(葉の窒素含量の減少)が,糖の蓄積と密接に関わること(2-7),老化に伴うルビスコの減少がsugar-repressionによって説明できることを示した(Ono and Watanabe. 1997 Plant Cell Physiol. 38: 1032-1038., Ono et al.の総説参照。)。新谷考央さん(現 ドイツ)は,糖の添加実験を行い,葉がシンクからソースに変化する際に糖への応答性がドラスティックに変化すること,窒素欠乏が老化を早めるという現象も,成長シンクが抑制されることによる糖の蓄積によって説明できること(2-8,2-9)を示した。 これまで,研究室ではC3植物ばかりを扱ってきたが,田副雄士さん(現 東北大学農学研究科牧野教授研究室ポスドク)は,C4光合成における光と窒素利用を解析した。弱光下では葉の内部の窒素分配は最適ではなく,弱光環境には馴化できにくいことを示した(2−10)。 |
原著論文
総説
|
(3)光阻害 (1988〜現在) |
| オーストラリア国立大でOsmond教授のもとでポスドクをしている時に、「低温における光合成の阻害には光化学系IIの光阻害が関与している」という仮説にたって、植物の低温−光傷害の研究を開始した。冷温感受性植物として知られるキュウリの葉を低温で光照射したのち室温で光合成活性を測定したところ、光化学系IIはほとんど傷まないのに光合成速度が低下した。このことは、光化学系IIの阻害は光合成を律速しないことを示している。光−低温処理を施した葉からチラコイド膜を単離したところ脱共役剤を加えなくても高い電子伝達速度を示した。また、薬剤の影響などから、チラコイド膜のH+-ATPaseのCF1の部分が遊離している可能性を指摘した(3-1)。
H+-ATPaseが損傷されるという説に対する反論(3-2)が出たので、さらに、ウエスタンブロッティングによる詳しい解析や、光−低温処理後の再結合の様子、蛍光や535 nmシフト、518 nmのelectrochromic shiftの解析を行った。これらの結果は、光-低温処理によりチラコイド膜のATPaseのCF1の部分が遊離し、室温にもどすと再び膜に結合することを強く示すものである(3-3,3-4,図7)。Ortたちは,この決定的とも思える論文に反論する論文を出版した(Oxborough and Ort, Photosynthesis Research 43: 93-105 (1995)。僕が負け戦をしたと思っている人も多いのは残念である。機会があったら反論論文を書きたい。H+-ATPaseの専門家久掘徹さんが,「お前のかたきはとってやる。」と言ってくれたが・・・。 |
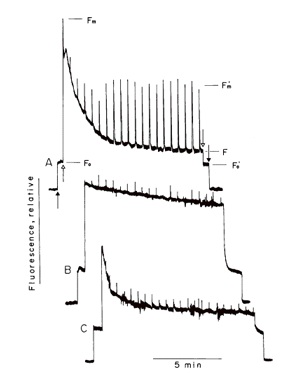 |
| 図7 キュウリの葉を,光−低温処理前後の蛍光誘導期現象の比較。A, 処理前;B, 処理直後;C, 処理後室温で暗黒条件に30分置いたもの。処理直後はNPQがほとんどない。室温に置くと,NPQが形成されるようになる。低温処理後,キノンは還元されており,電子伝達がキノンの下流で滞っていることを示している(光化学系Iが傷んでいるから!)。 |
| H+-ATPaseのCF1部分の遊離は可逆的なものであるが,キュウリ葉を光−低温処理すると光合成は不可逆的に失活する。その原因を探索するために卒研生だった舟山幸子さん(現 当研究室ポスドク)と光合成の様々な部分反応を測定したところ,光阻害には抵抗性が高いと思われていた光化学系Iが傷むことが明らかになった(3-5)。
園池公毅さん(現 早稲田大学 教育学部 理学科 生物学専修)が,ESRやフラッシュフォトリシスなどの物理学的測定によって,損傷部位は光化学系Iの初期電子受容体であるFA/FBやFXなどの結合型鉄イオウセンターであることが明らかにした(3-6, 3-7) 園池さんは,in vitroで,スカベンジャーを用いた実験を行い,鉄イオウセンターが傷むのは, Fe2+が存在する条件下で過酸化水素が作用して生じるヒドロキシルラジカル(Fenton反応)のためであるという可能性を示した(Sonoike, K. Plant Sci. 115: 157-164 (1996).)そこで,その可能性をin vivo条件でさらに検討した。これらの結果,光-低温処理時にチラコイド膜がH+-ATPase の損傷によって脱共役状態となることが重要な役割を果たしていることが明らかになった。まず,ΔpHが出来ないので過剰な光エネルギーを熱として逃がすことができなくなる。また,ATPが出来ないのでCalvin-Bensonサイクルが完全に止まってしまう。このため分子状酸素に多くの電子が流れ活性酸素を生じる一方,葉緑体の活性酸素消去系の酵素の活性は低温によって抑制され,活性酸素を完全に消去できない。こうして生じたH2O2が還元状態の結合型鉄イオウセンターが損傷する原因である(3-8)。光化学系Iに関しては,早稲田大学の園池公毅さんのホームページをご覧いただきたい。園池さんが多数の総説をお書きである。オウトウ(サクランボ)の光−低温障害に関する論文が未だに!準備中である(Dr. Ala Druta との共著)。光化学系Iが顕著にいたむ。 光化学系IIの光阻害:D3の宮田一範さんが,光化学系 IIの阻害と修復を生理生態学的に研究している。ホウレンソウの光化学系IIの阻害の修復活性は適切なレベルであり,活性がこれよりも高くても,それほど光合成生産には影響はないが,活性が低いと光合成生産が顕著に減少することを見いだした(3-9)。 光化学系IIの光阻害のメカニズムとして,現在,閉じた状態の光化学系II反応中心に到達したエネルギー(Excess energy)が阻害の原因であるとするExcess説,最初に水分解系のMnクラスターが傷み続いて反応中心が傷むとする2-ステップ説の2つがある。ポスドクで在籍した小口理一さん(現 東北大学生命科学研究科助教)は,単色光によって光阻害を誘起し,ミクロファイバーを葉に射し込んで葉の各部位の蛍光を解析することで,光照射条件によって,これらの2つのメカニズムが両方とも機能していることを強く示唆した(3-10,3-11,総説も参照)。今後,2つのメカニズムに関する詳細な検討が必要である。宮田さんが鋭意研究を進めている。 ポスドクで滞在したDetelin Stefanov(現 Sofia大学 生物物理学科)さんと,蛍光パラメーターを整理する研究も行った(3-12)。D3の河野優君が、変動光環境下での光化学系Iの光阻害の研究をしている。 |
原著論文
総説
|
(4)葉の光合成におけるCO2拡散,CO2拡散におけるアクアポリンの役割(1988〜現在) |
| ストレスが光合成に及ぼす影響を研究する場合に、葉の光合成速度を、細胞間隙のCO2濃度(Ci)に対してプロットしたA-Ci曲線を解析する。細胞間隙のCO2濃度は、蒸散や光合成速度にもとづいて計算する。ストレス処理前後でA-Ci曲線に変化がなければ、そのストレス要因は気孔以外に影響しなかったと判断される。アブシジン酸(ABA)を葉に作用させると気孔が閉じることにはどの研究者も認めていたが、葉肉光合成阻害の有無に関しては議論が分かれていた。
表皮を剥離した葉について光合成のCO2濃度依存性を測定すると、文献では葉肉光合成が阻害されるとされたヒマワリなどの異圧葉(heterobaric leaf)でも阻害が見られないこと、表皮が存在しても高いCO2濃度条件で測定した光合成速度に変化がみられないこと、ABAを作用させると気孔の閉鎖が葉面において空間的に不均一になること、などを明らかにした。気孔の閉鎖に伴い葉面の光合成が著しく不均一になるばあいには、計算によって求めたCiは過大評価であることを指摘した(4-1,図8)。出版以来300回ほど引用されている。 |
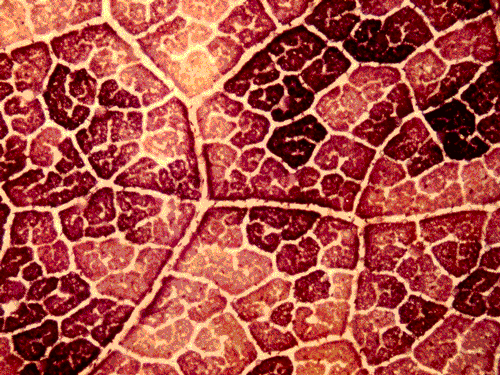 |
| 図8 アブシジン酸を作用させた葉に光を照射後,ヨウ素デンプン反応でデンプンの形成を調べた。葉脈に囲まれた区画ごとに光合成によるデンプン合成速度が著しく異なる。単純な実験でも面白いことが分かる。小学生の研究のようだが・・・。 |
| ガス交換と炭素同位体比の同時測定(OGで、現在京都工芸繊維大学の半場祐子さん)や、蛍光とガス交換の同時測定(4-5に最もインチキでrobustな方法あり)によって細胞間隙から葉緑体ストロマまでのCO2拡散抵抗や葉緑体のCO2濃度を推定することができる。これらのシステムを用いて、葉緑体内部のCO2濃度を推定したところ、常緑樹(4-2)や高山植物(4-3)ではかなり葉緑体内のCO2濃度が低下していることが明らかになった(図9, 10)。 |
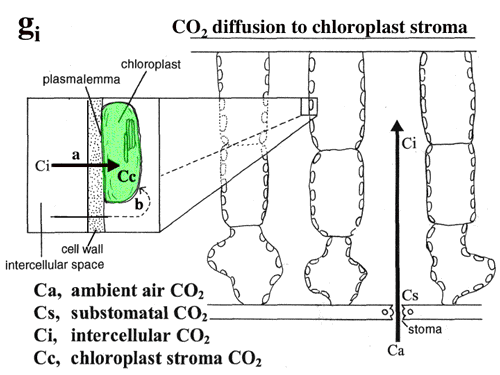 |
| 図9 大気中のCO2は大気中から気孔を通って細胞間隙に拡散し,細胞壁の水に溶け,細胞膜,葉緑体包膜を通って葉緑体ストロマに達してRubiscoによって固定される。 |
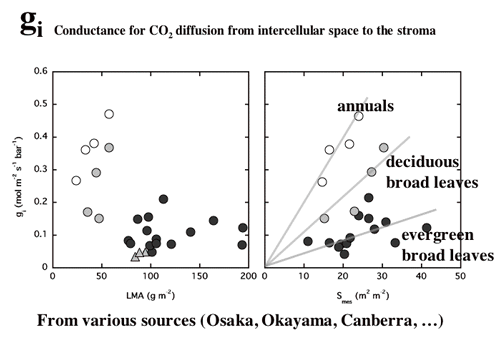 |
| 図10 一年生草本のタバコ,落葉広葉樹各種,常緑広葉樹各種の内部コンダクタンス(細胞間隙から葉緑体ストロマまでのCO2拡散コンダクタンス,葉面積あたりで表現してある)。葉面積あたりの乾燥重量の重い葉ほど,コンダクタンスは小さい。葉緑体がへばりつく細胞壁の表面積が大きいほどコンダクタンスは大きい。この依存性が,一年生草本,落葉広葉樹各種,常緑広葉樹の間で異なるのは細胞壁(CO2拡散のバリアとなる)の厚さがそれぞれ,約 0.1,0.2,0.4 µmと異なるためかもしれない。半場さんなどのデータによる。 |
| 簡単な拡散方程式を含む葉の光合成のモデルを構築し、細胞間隙の二酸化炭素拡散抵抗と細胞間隙から葉緑体ストロマまで抵抗(内部抵抗)の大きさを比較した。また、陽葉が陰葉よりも厚いのは、単位葉面積あたりの細胞間隙表面積を大きくするためである可能性を考察した(4-4,よく引用されるというので2004年Journal of Plant Research論文賞を受賞!, 図11, 12)。 |
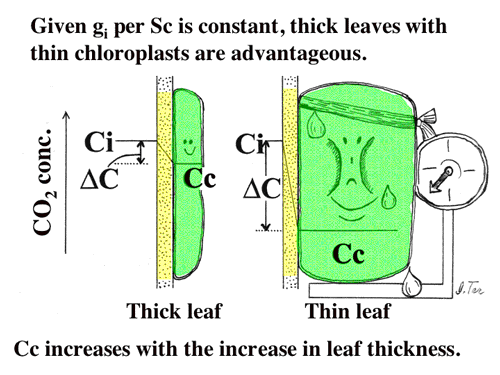 |
| 図11 葉面積あたり同量のRubiscoを持つ葉の葉緑体の様子。葉が薄いと葉緑体が太ってしまう。もし,葉緑体接触面積あたりの細胞間隙から葉緑体内へのCO2コンダクタンスが同じであるとすれば,ストロマのCO2濃度の低下は,太った葉緑体ほど著しくなる。これは光合成にとって不利である。 |
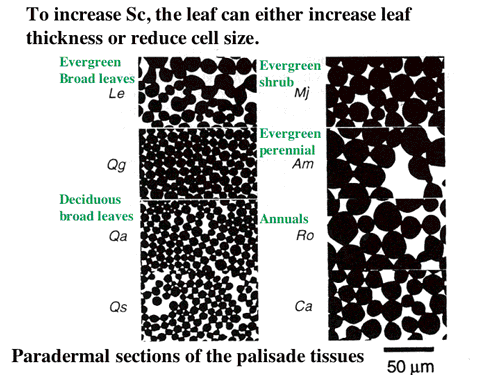 |
| 図12 葉面積あたりの葉緑体がへばりつく面積を大きくするためには,細胞を小さくするという方法もある。柵状組織の葉に並行な切片のシルエットを較べると,ひとことで柵状組織といっても細胞のサイズにはかなりの開きがあることが分かる。サイズはどういう要因で決まるのだろうか? |
| 細胞膜の拡散抵抗に関しても研究を進めている。1998年に,動物のアクアポリン(図13)の一種がH2OだけでなくCO2も透過させるという報告が相次いだ(例えばCooper & Born, 1998)。これらの実験はアフリカツメガエルの卵細胞や脂質人工膜を使って行われ,CO2の溶けこみにともなうpHの変化を測定することによりCO2の透過性を推定している。
植物の葉肉細胞のアクアポリンがCO2を透過するならば,内部抵抗はアクアポリンにも依存するはずである。 葉には優秀なCO2センサーである葉緑体があるので,pHの変化などはモニターする必要はない。HgCl2の存在下で光合成のCO2濃度依存性を測定してみればいいのではなかろうか。そう考えて,インゲンマメやソラマメの葉を水切りし,葉柄を水差しにさして光合成速度の気孔腔CO2濃度(Cs)依存性を測定した(これらの植物は葉の両面に気孔を持つのでCsと細胞間隙CO2濃度(Ci)とは大差はない)。光合成速度の測定と同時にクロロフィル蛍光を測定し,それをもとにCcを推定した。測定後,今度は水差しにHgCl2を加えて,同じ測定を行った。図はその結果である。光合成速度のCsへの依存性はHgCl2の有無で大きく異なった。 |
 |
| 図13 アクアポリンの構造。くの字に曲がったH2Oよりもラグビーボール型のCO2の方がスマート? |
| HgCl2存在下で同じ光合成速度を実現するためにはCO2濃度を高めなければならない。一方,計算によって求めたCcに対して光合成速度をプロットすると,HgCl2処理前後で依存性に変化はない。これらのデータは,Hg2+が細胞間隙から葉緑体までの内部抵抗を大きくしたことを示している。抵抗を計算すると,処理前の3倍程度に増えた。逆に言えば,Hg2+のない状態ではCO2拡散の大部分はアクアポリンのようなタンパク質に依存している可能性が高い。表皮を剥離したソラマメ葉片を濃厚なソルビトール液につけると脱水されるが,この脱水を阻害するHgCl2の濃度域と,内部抵抗を大きくするHgCl2の 濃度域とがほぼ一致したことも,この内部抵抗の増大は,アクアポリンの阻害による可能性を示唆しているこの内容を2001年の国際光合成会議のプレナリ−レクチャーで講演した(論文は,4-5)半場祐子さんや且原真木さんは,オオムギのアクアポリンをイネに発現させたイネの葉の内部抵抗はアクアポリンの発現量の増加にともない,顕著に減少した(4-6)。
高木慎吾さん(大阪大学大学院理学研究科)との共同研究で,葉内の二酸化炭素拡散における葉緑体定位運動の役割について調べ始めた(図14)。この問題に興味をもつDanny Tholen(現 上海 Max Planck-Academia Scinica 研究所)が外国人特別研究員として研究室に滞在し,シロイヌナズナの各種突然変異体を使った実験を行った。葉肉コンダクタンスは細胞間隙に接する葉緑体の面積に比例した。実験をはじめた当初,われわれは,葉緑体は強光下では光合成基質であるCO2によって光合成を律速されるので,細胞間隙に強光回避を優先させることがわかった(4-7)。 土壌乾燥時には気孔コンダクタンスと葉肉コンダクタンスとが同時に減少するという報告が多い。D3の溝上祐介さんは,ABA合成能を欠くタバコの突然変異体を用いてABAによる葉肉コンダクタンスの調節の可能性を探っている。 村岡裕由さん(現 岐阜大流域圏科学研究センター)らと野外における光合成の日中低下における二酸化炭素拡散律速の評価法を考案し,野外データに適用した(4-8) 。 ポスドクで滞在したPoonam Vyasさん(New Delhi大学)と,倍数体の葉の形態変化と光合成との関係を調べた(4-9)。 |
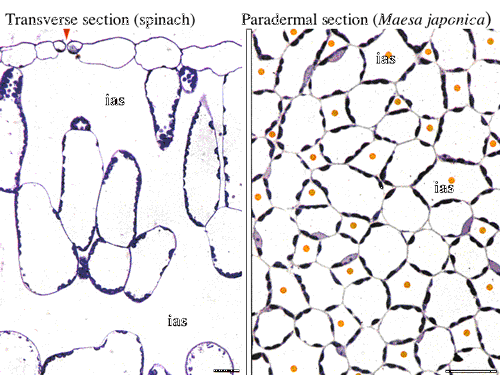 |
| 図14 ホウレンソウ葉の断面,イズセンリョウ葉の柵状組織部分の並皮切片。葉緑体は必ず細胞間隙に接した部分に存在する。この現象は1908年のSennの教科書に記載されているが,メカニズムは不明であり,高木さんとの共同研究のテーマとなっている。 |
原著論文
総説
|
(5)高山植物の光合成 |
| ヒマラヤにおいて高山植物の光合成速度を測定し(5-1)、低気圧下の光合成について理論的に検討した。高山では光合成の基質であるCO2分圧も低下するが、光呼吸の基質であるO2分圧も低下するので、比較的低温であれば気圧の低下による光合成速度の低下はそれほど著しくない。ただし、高山植物の葉肉細胞壁は厚いので、葉緑体内部のCO2濃度は低下しがちである可能性を指摘した(5-2)。
小神浩幸さん・半場祐子さんは、富士山に生育するイタドリについてこのことを実証した(5-3)。 |
原著論文
|
(6)樹木の光合成系の構築過程 |
| 樹木における光合成系の構造と機能の決定機構を,イヌブナとブナについて研究した枝の性質(葉の枚数,枝の長さ)は前年の光環境によって決定される。ブナにおいては葉の解剖学的な構造も前年の光環境によって決定されるが,イヌブナは当年の光環境のみに依存して構造と機能が決定される (6-1,6-2)。
僕の研究室では,木村(貴船)恭子さん(現在,口之永良部島ユースホステル)がこの分野の研究に着手し,研究室のプロジェクトとして取り組んで来た。今後は,樹木個体内部の炭素の動きを解析する予定である。追立浩貴さんがこの分野のパイオニアとしてトレーサー実験に取り組んだ(6-3)。 原著論文
総説
|
(7)学位論文など |
| 僕が付き合った学位論文のための研究は以下の通りです。野口さんが主に面倒をみた学位論文については野口さんのページをご覧下さい。 |
富士山の火山荒原の先駆種イタドリの群落がドーナッツ化するメカニズムの解明 |
| 足立直樹さん(環境研究所研究員を経て現在、レスポンスアビリティ代表取締役)の学位論文の内容。生態遷移現象は生物の環境形成作用が行われる場における種間競争として理解されがちである。しかし、先駆種であるイタドリは、自らの縞状群落の中央に穴をあけ、そこに後続種が侵入する。穴が空くのはイタドリの地下茎の分枝パタンによって説明できる。イタドリは中央部の富栄養化した場所から地下茎で養分を貧栄養な周辺部分に運ぶことも見出した。
|
原著論文
|
C3植物葉の光合成系構築における窒素利用について |
| 彦坂幸毅さん(現 東北大学生命科学研究科)の研究。(2)に少し書いてあるが,詳しくは彦坂さんのホームページを参照。
|
植物個体のサイズ分布におよぼす密度効果 |
| 長嶋(彦坂)寿江さん(現 東北大学生命科学研究科)の学位論文の一部。シロザの人工個体群の丹念な成長解析により,個体サイズの二山分布の成立要因,背揃現象の記載などが可能となった画期的な論文。
|
原著論文
|
葉の濡れによる光合成の不可逆的阻害の研究 |
| 石橋百枝さん(現 金沢百枝 東海大学文学部准教授)の学位論文の一部。人工降雨装置による葉の濡れが,気孔の部分的閉鎖などによって葉の光合成を短期的に阻害し,その状態が1日以上継続すると光合成の慢性的阻害をもたらす。この過程ではRubiscoがきわめて急速に分解される。 石橋さんは文系に転身!
|
原著論文
|
葉が植物個体内における自身のステータスを知るしくみ |
| 小野清美さん(現 北海道大学低温研究所)の研究。(2)を参照。 |
高等植物の呼吸系の生態生理学 |
| 野口航さんのページ参照
|
ウイルスの感染が植物におよぼす影響 |
| 舟山幸子さんのページ参照
|
葉の生態学的発生学 |
| 宮澤真一さん(現 農業生物資源研究所) は,常緑樹の葉の発生を研究した。教科書では,葉面積あたりの光合成速度は,葉面積展開が終了した時期に最大となると教えるが,常緑樹では面積展開終了時の光合成速度は低く,その後,1〜2週間かけて葉緑体が充実することを見出した。また,一年生草本植物の葉の大部分は,自身が稼いだ光合成産物を使って形成されるのに対して,常緑樹の葉を作る物質の大部分は植物体の他の部分から転流されてくる物質であることも明らかにした。枝の内部の物質の物質やシグナルのながれに注目した研究も行った。ポスドクでカナダ留学時の研究 ポプラの枝の基部の葉の気孔コンダクタンスが大きいと展開中の葉の気孔が多くなることなども見いだした。その後は,葉肉コンダクタンスにおけるアクアポリンのリン酸化に関する研究,現在はイネのPEPカルボキシラーゼの研究や,アンモニアの揮散の研究を行っている。
|
原著論文
|
陽葉と陰葉形成におけるシステミックシグナリング矢野覚士さん(現 司法書士に華麗に転職)は,陽葉と陰葉の分化のメカニズムの解明に取り組んだ。成熟葉が明るい環境にあれば,展開中の葉が暗い環境にあっても,厚い柵状組織ができる。成熟葉シグナルの実態の解明は今後の課題である。 |
原著論文
|
樹木の水分生理 |
| 齋藤隆実さん(現 名古屋大学地球水循環研究センターポスドク)は,細胞壁の弾性係数の環境依存性を初めとした一連の水分生理学の研究を行った。現在も水分生理学を継続中。齋藤隆実さんのHPにこれらの研究の詳しい解説がある。
|
原著論文
|
パイプモデルにもとづいた樹木の構築過程 |
| 曽根恒星さん(現 株式会社ブリヂストン中央研究所)は,樹木の構築におけるパイプモデルに注目した。パイプモデルとは,枝についている葉の面積の総和と枝の断面積との間に比例関係があるというもので,DaVinciが最初の発見者である。枝はその生産物を他の枝にはほとんど転流しないが,下流の大枝や根には転流する。枝自身で使う光合成産物と転流する産物との割合はどのように決まるのかは,未解決の問題であった。成長のよい枝は自身の光合成によってえられた光合成産物の大部分を自身で使っている。一方,暗い環境の枝は,光合成産物を下流に転流することによって,間接的に成長する枝を助けることになる。こうして枝間の成長に差が生じる。
|
原著論文
|
C4植物の窒素利用と、CO2濃縮回路におけるCO2の漏れ |
| 田副雄士さん(現 東北大学農学研究科ポスドク)は、僕の研究室で初めてC4植物に取り組んでくれた。まず、スギモリゲイトウ(Amaranthus cruentus)を強光下と弱光下で、窒素栄養の段階を変えて栽培し、光合成系の窒素分配を検討した。窒素分配は光によってそれほど変わらず、弱光下にうまく馴化できないことが示された。この研究では炭素安定同位体も測定したが、弱光下で栽培したものでは、かなりの炭素安定同位体分別がみられた(安定同位体比がC3植物に近づいた)。次の研究では、これがCO2濃縮経路におけるCO2の漏れによること、漏れる割合は弱光ほど大きいこと、弱光で栽培すると漏れが抑えられる傾向にあることがあきらかになった。博士課程修了後はオーストラリアで葉肉コンダクタンスの研究、京大でC4植物におけるサイクリック電子伝達系の仕事をして、現在に至っている。
|
原著論文
|
光合成の温度依存性 |
| 矢守航さん(現 千葉大学環境健康フィールド科学センター)は,光合成の温度依存性について研究した。ルビスコ,ルビスコ活性化酵素,葉肉コンダクタンス,などに注目して温度依存性の成立要因を解明した。また,これらを多くの種で比較した。
|
原著論文
|
光合成系構築のシステミック調節 |
| 新谷考央さん(現 ドイツ)は,葉の光合成活性や老化の糖による調節,および成熟葉の光合成環境および光合成速度が若い葉の光合成活性におよぼす影響について研究した。現在は根の形態形成の研究をしている。
|
原著論文
|
気孔の環境応答 |
|
Wang Yinさん(現 名古屋大学理学研究科特任助教)の研究。王さんは,無傷葉の光合成速度と気孔コンダクタンスを向,背軸側別々に同時に測定できる光合成測定システムを構築して,光以外の環境要因であるCiや空気湿度を一定にして,一定の栽培条件で育てたヒマワリの成熟葉の向,背軸側の気孔の光応答を調べた。また,葉を裏返して光環境を変えた場合の気孔の光環境応答の変化について調べた。生態生理学的視点から,気孔の光応答のメカニズムを考察した。
|
原著論文
|
葉の大きさの研究:光合成モデルとエネルギー収支モデルの融合 |
| 岡島有規さん(現 住友化学宝塚総合研究所)は,Farquharの光合成モデル,Leuningの気孔環境応答モデル,をエネルギー収支式モデルと結びつけて,種々の気候条件で最適の葉のサイズを求めた。この論文はEcological Research論文賞を受けた。
|
原著論文
|
葉柄の光屈性 |
| 藤田佳子さん(現 住友化学宝塚総合研究所)は,葉が表側に光を受けるように葉柄が屈曲するメカニズムを解析しました。葉柄に裏側から光が当たると葉柄は反り返り、葉柄の表側からの光を十分受けるようになるまで屈曲を続ける。反り返りには青色光がもっとも有効であり、表側からの光は青色光と赤色光の両方が有効であった。赤色光はフィトクロムである可能性が高い。
|
原著論文
|
寺島一郎 略歴1957年5月28日 福岡県筑豊の宮田町(現宮若市)生まれ,佐賀育ち。 1973年4月 佐賀大学附属中学をへてラサール高校入学。
1976年4月 公害をなくすため!に,生化学をやろうと思って東京大学理科二類入学。 1985年3月 東京大学大学院理学系研究科植物学専攻・博士課程修了。 1985年4月 日本学術振興会奨励研究員として駒場へ。
1985年10月 ポスドクとしてオーストラリア国立大学へ
1988年9月 東大理学部助手となる。 1994年4月 筑波大生物科学系助教授となる
1997年10月大阪大学理学部の教授となり生態生理学の研究室を創設 2006年4月東京大学大学院理学系研究科の教授として異動,植物生態生理学研究室を復活する。 |