時計タンパク質CRY2のリン酸化メカニズムとその概日リズム制御における役割
約1日の生物リズムを生み出す概日時計は、生物に普遍的かつ重要な生理機能であり、その周期の乱れは規則正しい睡眠-覚醒や食事のリズムに影響を及ぼします。概日時計の分子発振は、時計遺伝子の転写活性化が適切な時刻にオンとオフの制御を受けることによって24時間の周期を正確に維持しています。この分子発振において、時計タンパク質CRY2は時計遺伝子の転写活性化を強力に抑制します。そのため、CRY2が適切な時刻に発現して時計遺伝子の転写を抑制し、適切な時刻に分解して転写の抑制が解除されるプロセスは、概日時計の周期決定に極めて重要であると考えられます。
深田研究室の倉林らは、DYRK1Aという新規のタンパク質キナーゼがCRY2の557番目のSer残基(Ser557)をリン酸化することを見出しました。DYRK1Aによりリン酸化されたCRY2は、さらにGSK-3βによって Ser553がリン酸化され、2段階にリン酸化されたCRY2はプロテアソーム分解へと導かれます。重要なことに、マウス肝臓におけるDYRK1AのCRY2 Ser557リン酸化活性は、CRY2が蓄積する時間帯をピークとする日周変動を示しました。さらに、Dyrk1aを培養細胞においてノックダウンすると、約0.5時間の時計周期の短縮が認められました。Dyrk1aノックダウン細胞におけるCRY2タンパク質量の日周変動を核と細胞質にわけて調べたところ、細胞質においてはCRY2タンパク質量が一日を通して異常に高いレベルを示しました。一方、核内のCRY2の最高レベルと最低レベルは殆ど変化しないものの、正常よりもCRY2がより早いタイミングで蓄積しはじめる様子が観察されました(図1)。以上の結果から、DYRK1AはCRY2が蓄積する時間帯において細胞質CRY2の分解を促進し、CRY2の核移行タイミングを遅延させるという重要な機能を持つと考えられました(図2)。つまりCRY2のSer557リン酸化による分解制御は、時計遺伝子の転写抑制時刻の遅延メカニズムとして時計の周期を調節すると考えられます。
本GCOEプログラム事業推進担当者
理学系研究科生物化学専攻教授 深田吉孝
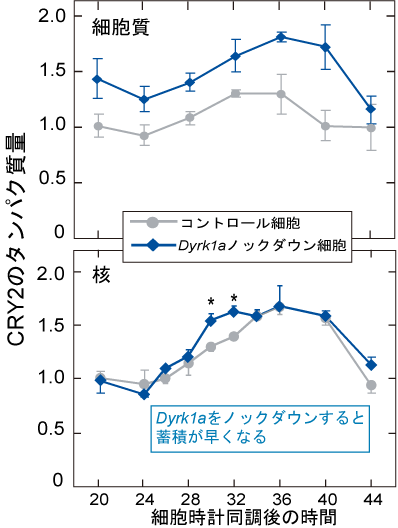
図1 Dyrk1aノックダウン細胞におけるCRY2タンパク質の日周変動プロファイル
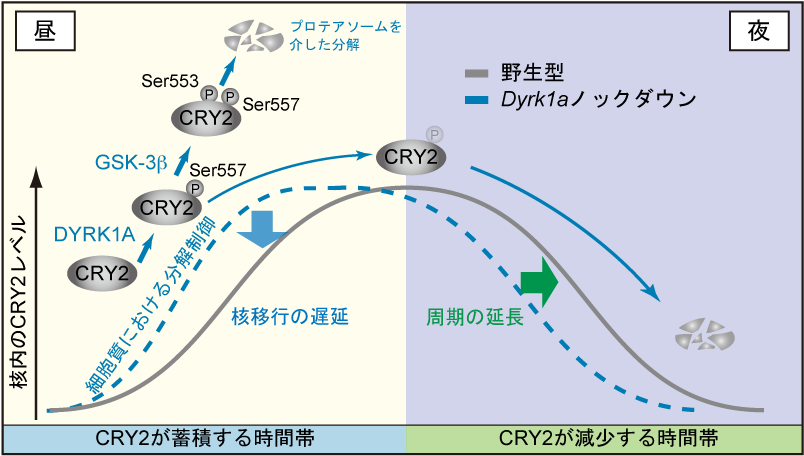
図2 DYRK1Aのリン酸化依存的な分解によるCRY2タンパク質レベルの制御モデル
