ペプチドニューロンの神経生物学−ホルモンとしてはたらかない「ペプチドホルモン」は脳の中で何をしているのか?−
Comparative Physiology and Biochemistry 19: 120-127 (2002)
岡 良隆(東京大学大学院理学系研究科附属臨海実験所)
okay@mmbs.s.u-tokyo.ac.jp
はじめに
最初に、この文章は日本比較内分泌学会ニュースレター92号に掲載された文章を、日本比較内分泌学会広報委員会及び日本生理生化学編集委員会の了承を得て、一部を加筆・修正したものであることをお断りしておきたい。
生殖腺刺激ホルモン(ゴナドトロピン)放出ホルモン(GnRH)は、視床下部ニューロンの細胞体で産生され外的・内的環境の変化に応じて正中隆起の軸索終末から下垂体門脈血中に分泌されて下垂体からのゴナドトロピン放出を促進する「脳下垂体刺激ホルモン」として発見され(GuilleminとSchallyの「ノーベル賞の決闘」で有名)、それ以来、教科書的に最もよく知られるペプチドホルモンである。ところが、最近になって免疫組織化学やin
situ hybridizationの手法によりペプチド産生ニューロンの細胞体や神経線維の分布が形態学的に詳細に調べられるようになり、GnRH神経系の多様性がクローズアップされるようになってきた。すなわち、GnRHは視床下部以外の脳内に分布するニューロンでも産生され、さらに、これらのニューロンは正中隆起には軸索を投射せず、脳内に広く神経線維を投射していることがわかってきた。したがって、これらの視床下部外GnRH系が産生するGnRHはいわゆる「ゴナドトロピン放出ホルモン」としては働き得ないことになる。それでは、ホルモンとしてはたらかない「ペプチドホルモン」は脳の中で何をしているのか、という素朴な疑問から我々の研究は始まった。
視床下部外GnRH系は神経修飾系としてはたらくのではないか?
一般に脳における情報処理はニューロン間のシナプス結合によって形成される神経回路において行われる。この場合感覚入力から運動出力への変換は神経回路のアルゴリズムにしたがって極めて正確に行われる。一方、動物は外界からの入力に対して常に一定した応答を示すのではなく、多様な環境の変化に対応して適応的かつ合目的的に柔軟な応答をする能力を備えている。このとき環境変化の受容系と行動・内分泌的適応の仲介をして神経系の機能に柔軟性を持たせる重要な役割を演じているのがペプチド神経系である、というのが最近の我々の研究室における作業仮説である。本章ではこのように考えるに至った経緯を紹介しようと思うのだが、我々の研究の詳しい内容についてはすでに最近レビューしており1)~5)、また、GnRHニューロンの形態学的・電気生理学的特徴に関しては、98年に学会出版センターから我々の研究仲間(低次脳機能研究会、略して「低脳研」。「低能」ではないことに注意!;余談になるが、90年に私と神経研の市川眞澄さんが呼びかけてGnRH研究会と言う名称で活動を初めて以来、現在までに30回あまりの研究会と3回の国際シンポジウムを開催している。私がGnRHニューロンの仕事を始めた直後にこの会の結成を呼びかけたので、この研究会と私のGnRH研究は共に歩んできた、という強い思い入れがある。http://www.mmbs.s.u-tokyo.ac.jp/Oka/GnRHact.html参照)が出版した「脳と生殖−GnRH神経系の進化と適応」という本の中で詳しく述べられている4)。この本においては低脳研の各メンバーによりGnRH神経系が様々な観点から論じられているので是非一読をおすすめする。というわけで、宣伝はさておき、本章ではこれらのレビューには書けなかったような研究の舞台裏や本音の部分(!)、およびその後の研究の発展や希望的観測(?)について述べてみようと思う。その点で、この文章がこの分野の最先端研究を紹介するレビューにはならず、多少エッセイ的になってしまうことをお詫びする。興味を持たれた方は文献1)〜5)をお読みいただきたい。このようなエッセイ風の文章を比較生理生化学会誌に再投稿しようと思ったのは、かつて大学院時代に使っていた形態学の技術だけに頼って仕事をしていた私が、ある日思い立って新しい技術(電気生理学や分子生物学など)を取り入れながら新しいテーマに取り組んできた生々しい過程をさらけ出す(!)ことによって、何人かの若い読者の方に新しいことにチャレンジする勇気を持っていただけることを願ったからである。
ドワーフグーラミーという魚との出会い
現在我々の研究室では、ドワーフグーラミー(Colisa lalia)という、熱帯魚としてはポピュラーで入門的な魚だが実験動物としてはほとんど無名の動物を主に用いて研究を行っている。実際、現在の私の研究室がある「臨海実験所」で多数の淡水産熱帯魚が水槽室だけでなく実験室でも多数泳いでいる様を初めて見る訪問者の頭には、一瞬「何をまた酔狂な!」という思いがよぎることだろう。ところが、この動物は脊椎動物のGnRH神経系(ひいてはペプチド神経系一般)を研究する上では、他の脊椎動物にはない、極めて実験に有利な点を持っているのである。すなわち、通常、ほとんどの脊椎動物のペプチドニューロンはその細胞体が直径10ミクロン前後と小型であり、しかも脳内に散在していて同定が大変困難であるが、後述する、ドワーフグーラミーの終神経GnRH細胞と呼ばれるGnRH細胞はその形態的・生理的特徴から、生きた脳で容易にGnRH細胞であることを同定した上で電気生理学的・細胞生物学的実験ができるのである。このGnRH細胞は、細胞体の直径が20〜30ミクロンと大型であり、しかも、細胞体同士がグリア細胞を介さずに密着して20個程度の細胞塊として存在している。さらに、この細胞塊は脳の結合組織の真上に左右1対存在しているので、脳全体を取り出して結合組織を取り除き、脳の腹側を上にして置くと、この細胞塊が実体顕微鏡で見えるようになる。これによって、細胞を目で見ながら細胞内電極を刺入したりパッチピペットを押しあてたりすることができる。さらに、細胞体全体が露出した状態になっているためか、酸素や溶液の供給が十分に早く行われるらしく、脳を丸ごと取り出して
in vitro の状態でこの細胞から電気的活動を長時間記録することができる。したがって、脳の中で組織としての有機的環境を保持したままで単一のGnRH細胞の生理学的・細胞生物学的な性質を調べることが可能である。さらに特筆すべきことに、後述するように、これらの大型の細胞体から直接GnRHが開口分泌により放出されていることが我々の最近の研究からわかってきた。一般には、直接測定の困難なシナプス終末や軸索のバリコシティーにおいてペプチドニューロンからのペプチド放出が行われることを考えると、このことは技術的に多大なメリットとなる。一方で、神経修飾作用の個体レベルでの効果は行動学的観察によって研究する必要があるが、ドワーフグーラミーは熱帯魚であり、年間を通じて性的に成熟した雌雄の個体を得ることができ、明確な性行動パターンを持っているため、神経行動学的解析にも適している。このように、ドワーフグーラミーのGnRH細胞はペプチドニューロンの神経生物学的研究を行う上で、ほかの脊椎動物では得難い多数の利点を持っている。ところが、このドワーフグーラミーとの出会いは全くの偶然であったのだから、人生はおもしろい。
話は1985年にさかのぼる。この年の1月、私はシンガポール大学において学術振興会派遣研究者として2週間の共同研究を行う機会を偶然得た。このころ私はヒキガエルを用いて本能行動の神経機構を形態学的手法で研究する、というテーマで仕事をしていたので、実のところ、シンガポール大学で行うべき、アカデミックに適切な(?)テーマを見つけるのに苦労した。その時思いついたのが、当時シンガポール大学に職を得ていたスコットランド人のAngus
Munroと言う男が使っていた魚の話である。彼の話はその前年に東京で交流シンポジウムがあったときに聞いたことがあり、何でも、彼の使っているドワーフグーラミーという魚は産卵行動を1年中観察できるので便利らしい、ということだった。一方で、私は大学院の研究でキンギョを用いて嗅覚系の研究を行ったこともあり、研究室全体の共同研究としてヒメマスの性行動神経機構の研究にも関わっていた。この関係で、83年にScience誌に発表されたDemskiと
Northcuttの論文6)は我々の研究室のメンバーに大変面白がられていた。これは、嗅球の近くに存在するTerminal
nerve(終神経)が性フェロモンの受容系としてはたらいて性行動を促進する、と言う論文である。しかも、このニューロンはGnRHに免疫陽性であって、軸索を視神経にも延ばしており、視神経を電気刺激すると終神経細胞が逆行性に刺激されるために放精が起きる、という何ともセンセーショナルな話であった(注:これに関してはその後、何の追試も得られず、また、これを否定すべき証拠の方が多くなっており、厳密性を欠いた実験の結果を思いこみたっぷりに論じた無責任な論文の典型である、と私は思っている)。そこで私は、2週間の間に、この魚を用いて終神経系の形態を調べる実験と、終神経系も含めた嗅覚系の破壊が性行動に及ぼす効果を見る実験をすることにした。短い期間ではあったが、終神経系の形態学的な実験はうまくいき、帰国後すぐに論文にまとめることができた。行動学的実験は思惑通りにはいかなかったのであるが、ドワーフグーラミーという魚が産卵行動を指標として行動実験を行うのに適していることや、手術に強いことに大変印象を受けた。
先にも述べたように、当時は研究テーマが別にあったので、その後しばらくはこの魚のことを忘れて研究していた。しかし、それから数年経って90年前後に、自分としても独自の研究テーマを見つけたいと思い始めた頃、この魚のことを思い出したのである。当時はちょうど、神経科学の分野においても免疫組織化学が流行してきて、ペプチドニューロンが視床下部以外にも多く存在して脳の各部位に分布している、という知見が少しずつ出始めてきた頃であった。そこで、前述の終神経系にGnRH免疫陽性線維が存在するらしい、と言うことを確かめるところから初めて、生理学的・形態学的・行動学的にも面白そうな終神経系の機能に迫ってみたい、と思い立ったのである。まず手始めにこの魚の入手経路を探してみたところ、田端に東京水族館という熱帯魚屋の問屋があるらしい、ということがわかった(東京水族館には7・8年お世話になったが、2・3年前に店を閉じてしまった。長年都内有数の熱帯魚問屋であったが、残念である)。この熱帯魚がポピュラーなこともあって、ここから、年間を通じて性的に成熟した雌雄の個体を容易に入手できた。また、飼育も特別な設備や技術を要せず、容易であった。それまでは研究室で、実験動物の入手と飼育だけで多大なる時間と労力を費やしていたので、これは大変ありがたかった。こうして私のドワーフグーラミーとのつきあいは始まった。
終神経GnRH細胞は脳内に広く神経突起を伸ばしている
最初に、群馬大学の若林先生の研究室から分けていただいたGnRH抗体(後に私の同僚となった現東京大学の朴民根さん=現在当研究室の助教授=が作成した)を用いて免疫組織化学を行った。すると、まず、嗅球と終脳の境界部にGnRH免疫陽性の巨大な細胞塊が目に付いた。これが終神経GnRH細胞であった。後に電顕観察で明らかになったが、これらの細胞体はグリア細胞を介さずに密着しているので、実際、個々の細胞体の輪郭があまりはっきりしないほどであった。また、連続切片を作成してみると、脳の端から端まで、ほとんどすべての切片にGnRH免疫陽性線維が存在していた。このようなGnRH線維の脳内の広い部位における分布は、脊椎動物の中でも魚類で最も顕著であるが、とりわけ、ドワーフグーラミーにおける終神経GnRH神経系の発達具合は特筆すべきものであった。GnRH神経系については、その後の研究から、「名実ともに」ゴナドトロピン放出ホルモンとして働く視索前野GnRH系、今回の話題の中心である終神経GnRH系、そして中脳GnRH系の少なくとも3つの形態的・機能的に多様なGnRH系が存在していることが脊椎動物を通じて共通の性質として認められている1-5)。後2者がゴナドトロピン放出ホルモンとしてはたらかないGnRH系であると考えられ、しかも、脳内に広く存在する高密度のGnRH線維の大部分はこれらに由来している。実際、小林らがキンギョで調べたところでも、RIAで計測できる組織中のGnRHの大部分が終神経由来のものであること(逆に言うと、脳内で生殖に関与しているGnRHの量は脳内のGnRH全体からすると「カス」のような程度しかない;文献4)の小林の章を参照)、そしてそれらは卵巣の発達や排卵にはまったく影響を及ぼさない事がわかっている。すなわち、脳内にはゴナドトロピン放出には関与しないGnRHの方がゴナドトロピン放出ホルモンとしてはたらくGnRHよりも圧倒的に「目立つ」存在なのである。
組織標本の中でも目を見張るべき存在感を示す終神経GnRHに興味を持った私は、是非この細胞に細胞内電極を刺してみたいと思った。それは、細胞内電極を用いることによって、GnRH細胞の電気生理学的性質がわかるだけでなく細胞内染色により単一細胞の全体像がわかるからである。当時私自身には電気生理学の経験が全くなかったが、同僚の松島俊也さん(現名古屋大学)が外国留学から一時帰国しているときに数日間手ほどきを受けて細胞内記録に挑戦した。当時、松島さんは両生類の脳ブロックのin
vitro標本で電気生理を行う技術をドイツで開発していたので、それに習って、プラスチックディッシュを加工した記録槽を急遽作成して、ドワーフグーラミーの脳全体を取り出してそれを正中で半切したものをピンで留めて記録を開始した。この時は、結合組織を取り除くと細胞塊が顕微鏡で見えるようになる、ということにはまだ気づいていなかった。矢状断の脳ブロックを実体顕微鏡で観察し、矢状断の免疫組織化学標本と見比べながら細胞内電極を刺していったところ、幸運なことに、実験開始の初日に細胞内に電極を刺すことができた。電極が細胞内に刺入される瞬間というのは常に感動的なものであるが(細胞内電位が急激に−数10mVになると同時にサウンドモニターから軽やかな活動電位の音がポンポンと響き渡る)、この細胞に電極が刺さると、格別のおもしろさがあった。それは、多くのニューロンにおいては刺入直後にinjury
spikeがしばらく出た後は何らかの刺激をしないと活動電位はほとんど見られないのだが、この細胞においては電極が細胞内にある限り活動電位が出続けることである。しかもこの自発活動は極めて規則的であった(図1)。これが後述する終神経GnRH細胞のペースメーカー活動であり、コンピューターのモニター(もしくはオシロスコープの画面上)で見ていると、まさにドクドクと脈打つ心臓の拍動のようである。Beginner's
luckというのであろうか、細胞内電極に詰めたLucifer Yellowによる細胞内染色もすぐにうまくいった。蛍光顕微鏡の視野で暗黒の背景の中にキラキラと明るく黄色に輝く終神経GnRH細胞はまさに花火のように見えた。同時に驚いたのは、連続切片を作成すると、1個の細胞を染めただけにもかかわらず、ほとんどすべての切片にそのニューロンに由来する突起の断片が含まれていたことである。後にビオチン複合体を用いて細胞内染色して明視野観察し、すべての断片をトレーシングペーパーに描き取ってからニューロンの全体像を3次元再構成すると(余談になるが、この再構成の作業には1個のニューロンについて1週間の時間を要した)、1個の終神経GnRH細胞から伸びる神経突起は、前後は嗅球から脊髄に至るまで、側方にも細胞体と同側の視蓋の最外側部から対側の視蓋の最外側部までの、実に広い脳部位に分布していた7)(図2)。これは1個のニューロンの持つ神経突起の広がりとしては脊椎動物のニューロンでは未だかつて報告がないほど広いものであった。1個のニューロンがこのように広い部位に投射しているので、片側約10〜20個しかない終神経GnRH細胞でも免疫組織化学で見たように、嗅球から脊髄までの実に広い脳部位にGnRH線維を供給することができたのだった。こうした終神経GnRH細胞の形態学的特徴は、後述するように、終神経GnRH細胞が広い脳部位に存在する標的細胞(GnRH受容体を持ったニューロン)の興奮性を一斉に修飾するのに適していると考えられる。
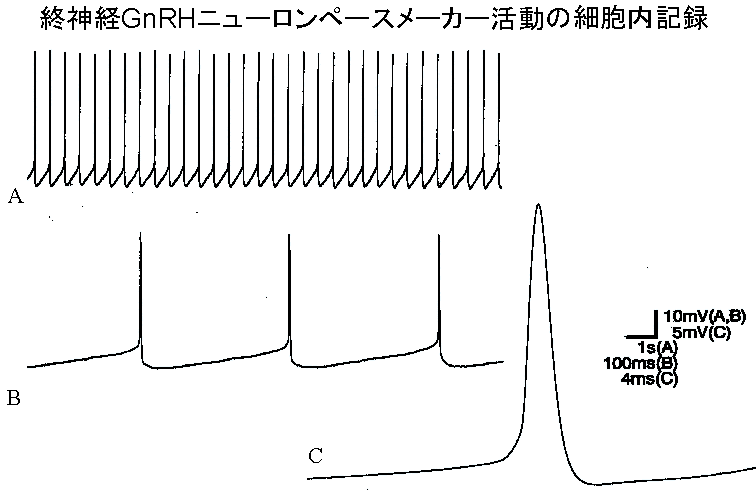
図1。終神経GnRHニューロンペースメーカー活動の細胞内記録。A~Cのトレースはそれぞれ違った時間軸上に示されている。
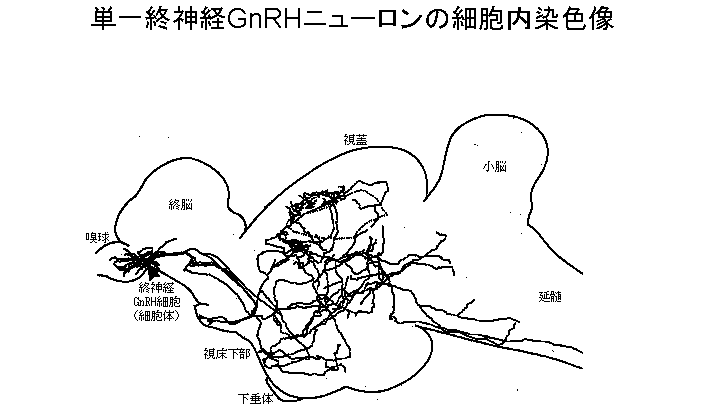
図2。細胞内染色された単一終神経GnRH細胞(細胞体および神経線維)の連続切片3次元再構成図(脳全体の傍正中縦断面に投影したもの;図左が脳の前方)。矢頭の部位にある1個の細胞体から脳内の極めて広い部位に3次元的に神経線維が分布している。
終神経GnRH神経細胞はペースメーカー活動をしている
上述したように、終神経GnRH細胞は極めて規則的な自発的ペースメーカー活動をしている。しかも、この終神経GnRH細胞の示すペースメーカー活動の頻度についてはおもしろいことがわかった。ペースメーカー活動の頻度は個体によって違っていたが、同一の脳標本において複数の異なる細胞からペースメーカー活動を記録すると、頻度がほぼ一定であった。この観察から、終神経GnRH細胞のペースメーカー活動の頻度は何らかの動物の生理的状態を反映して一斉に変化しうるのではないか、と考えた。そして、我々はこのペースメーカー活動を形成している神経機構と活動頻度の変化のメカニズムを調べてみようと思った。まず、細胞内記録実験から、テトロドトキシン(TTX;いわゆる「フグ毒」)に耐性のある持続性ナトリウムチャネル(つまり、活動電位発生に関与している従来のナトリウムチャネルとは性質の異なる、新しいタイプのイオンチャネル)が重要な役割をしていることがわかってきた8)。そこでこのイオンチャネルの性質をよく調べるとともに、イオンチャネルの修飾現象に関しても研究を進めるために、パッチクランプの実験を行う必要性を感じるようになった。もちろん、私自身もパッチクランプはやったことがなく、研究室内にもそうした技術を持った人はいなかったので、免疫組織化学や電顕観察をやるときに出入りさせてもらった都立神経研で知り合った久保義弘さん(現東京医科歯科大学)の研究室と、通勤途上よく出会った東大脳研神経生物の高橋国太郎先生の研究室にちょくちょくおじゃまして実験セットを見せてもらったり、実験に必要なプログラムをいただいて自分で書き直したりしながら、パッチクランプの実験を開始した。しかし、脳全体を取り出して記録槽に止めただけの標本で、細胞内記録を行うのと同じようにしてパッチピペットを脳内に押し込んでも、いっこうにパッチクランプに必要なギガシール(パッチピペットと細胞膜との間の強力なシール)ができずに、時間だけがむなしく何ヶ月か過ぎていった。一般的にはパッチクランプを行うには細胞表面が滑らかで露出されていることが望ましい、と考えられていたので、研究室の先輩で当時生理研にいた山口和彦さん(現理化学研究所)に相談したところ、膜電位固定法を行うことも考えて、終神経GnRH細胞の解離細胞を作ってみてはどうか、と勧められた。そこで、私はドワーフグーラミーをビニール袋に入れて東京から岡崎まで赴き(ドワーフグーラミーは実に酸欠に強いので、簡単に長時間持ち運ぶことができ、この点でも便利な魚である。)、数日間解離細胞の作成とパッチクランプの技術習得を試みた。残念ながら、ドワーフグーラミーの脳は、通常ほ乳類の脳から解離細胞を作るような条件では全くびくりともしないような、強靱な組織であった。また、細胞の個数も少なくて回収効率が悪そうだ、ということで解離細胞の作成はとりあえず断念した(実は、後述するように、細胞体からの開口分泌を直接記録する実験に使う目的で、GnRHニューロンの解離細胞の作成を現在、再び試みている)。しかし、このときに、脳から解離細胞を作るときには必ず脳表面の結合組織を取り除く、と言うことを教わった。これにヒントを得て、岡崎から帰った後に、脳全体を取り出してから結合組織をピンセットではがして(この作業は多少手先に器用さを必要としたが、かつて発生学の学生実習で上皮組織と結合組織をピンセットで分けた経験を思い出しつつ行った)記録槽に脳の腹側を上にして置いてみた。すると、驚いたことに、実体顕微鏡を覗くと、今まで血管と神経束を目印にして半ばめくら刺しで細胞内電極を刺していた場所に、もっこりと盛り上がった構造が見えるではないか!この標本でパッチクランプを行ってみると、見事にギガシールが形成されて、5時間もの間同一細胞で連続記録ができたのである。
この日の夜、初めてうまくいった実験に心うきうきさせながら家路に向かうとき、空には満月がぽっかりと浮かんでおり、まさに実体顕微鏡下に顔を見せた終神経GnRH細胞のようであったのを強烈に覚えている。このような形で、実体顕微鏡下で見ながら同定できるようなペプチドニューロンには未だに文献的にもお目にかかったことがなく、国内外の学会でこの実験標本を紹介するときには多くの人に強い興味を持っていただいている。
こうして、現在我々の研究室で日常的に用いている実験標本が生まれたのである。この標本を用いてイオンチャネルの性質を調べるためのホールセルクランプ膜電位固定法や、細胞内電極よりも安定して長時間ペースメーカー活動の記録ができ、細胞内に各種の化学物質などを導入できるホールセル電流固定記録法が適用できるようになった。この結果、現在までに終神経GnRH細胞のペースメーカー活動の生成・修飾メカニズムについて次のようなことがわかってきた。上述のTTX耐性持続性ナトリウムチャネルが終神経GnRH細胞のペースメーカー電位発生に必要な持続的内向き電流、すなわち持続的脱分極性駆動力を発生させていると考えられる9)。一方、持続的脱分極性駆動力に対して、ある膜電位まで脱分極が進むと膜電位を過分極側に引き戻すような機構が働くと規則的なペースメーカー電位が生じると考えられるが、それにはテトラエチルアンモニウム(TEA)感受性の膜電位依存性カリウムチャネルが最も重要な役割を果たしていることが示唆された10)。こうして主に2つのイオンチャネルの働きによってペースメーカー電位が発生すると考えられ、この電位が活動電位の閾値に達すると通常のナトリウムチャネルが活性化されて規則的な活動電位が発生するのである。一方、最近の結果から、終神経GnRH細胞には何種類かのカルシウムチャネルも存在していることがわかってきたが、中でもN型カルシウムチャネルがペースメーカー活動の活動電位発生時に賦活されること、さらに容量性カルシウム流入チャネルが何らかの形でペースメーカー活動の生成に関与していること、そしてこれらが神経修飾を受けることによってペースメーカー活動の頻度やパターンが変化することなどもわかってきた。これに関しては、終神経GnRH細胞自体にGnRH受容体が存在していて各種イオンチャネルがGnRH細胞の放出したGnRHによる神経修飾を受けることによりペースメーカー活動の頻度やパターンが修飾される、ということを発見したことにより研究が進んだ11),12)。さらに、かつて大学院生として私と一緒に仕事をしてくれていた山本直之さん(現日本医科大学)により終神経GnRH細胞にシナプス入力する神経核が最近同定された13)。その結果、終神経GnRH細胞が体性感覚・視覚性入力を中脳被蓋の被蓋−終神経核(nucleus
tegmento-terminalis)から,嗅覚性入力を嗅球や終脳の嗅球投射領域から受け取っている可能性が示唆された。さらに最近,終神経GnRH細胞には新規の型も含む何種類かのグルタミン酸受容体が存在していてグルタミン酸作動性シナプスの活性化によって終神経GnRH細胞のペースメーカー活動頻度が上昇するという可能性が示された。また,文献的にはティラピア(Oreochromis
niloticus)の終神経GnRH細胞には甲状腺ホルモン,テストステロン,コルチゾールなどのホルモン受容体が発現していてこのようなホルモンが終神経GnRH細胞のGnRH遺伝子発現の調節も含めた活動調節に関わっているという可能性も示唆されている14)。このようにして,ホルモンや神経伝達物質により終神経GnRH細胞イオンチャネルの働きが修飾される結果ペースメーカー活動の頻度やパターンが変化すると,GnRH放出量も変化すると考えられる。そして脳内に広く投射する神経線維から放出されるGnRHによって広範囲の標的神経細胞(GnRH受容体を持つニューロン)でカリウムチャネルやカルシウムチャネルが神経修飾される結果,標的神経細胞の興奮性や伝達物質の放出効率などが一斉に修飾される,というのが現在我々の考えているモデルである(図3)。さらに現在,
GnRH受容体を持つ標的ニューロンの脳内分布を調べるために朴民根さん達と共同でGnRH受容体のクローニングを行い,in situ
hybridizationによるマッピングを開始したところである。
このモデルに関連して、ペプチド同様神経修飾作用を持つといわれているモノアミンを産生するニューロンについていくつかの興味ある結果が最近得られている。それは、背側縫線核のセロトニンニューロン、青斑核のノルアドレナリンニューロン、黒質および腹側被蓋野のドーパミンニューロン、視床下部のヒスタミンニューロンなどである。これらのニューロンについては主に脳スライスを用いた電気生理学的研究が行われているが、すべてのニューロンにおいて共通するのは、それらが終神経GnRH細胞に類似したペースメーカー活動をしていることである。さらに、これらのニューロンの投射様式についても終神経GnRH細胞との類似性が認められる。モノアミンニューロンにおいては終神経GnRH細胞の場合のような単一細胞の細胞内染色による形態学的解析はまだ行われていないが、免疫組織化学による細胞体と神経線維の分布に関する観察はされている。すなわち、いずれのモノアミンニューロンも細胞体は限られた脳部位に比較的少数存在しているにもかかわらず、神経線維は極めて広範囲の脳部位に広がっている。このように、神経修飾作用が想定されているペプチドニューロンとモノアミンニューロンの両者で形態学的・電気生理学的な特徴が類似しているのはそれらのニューロンの機能を考える上で大変興味深いことで ある。
GnRHの神経修飾物質としての働きについては、中枢神経系における研究は少ないが、交感神経節細胞において最近比較的良く調べられている。現在までに、カリウムチャネルの一種がGnRHによって抑制されるために標的ニューロンの長期にわたる興奮性上昇が起きること15)や、シナプス伝達に関与すると考えられるカルシウムチャネルに対してGnRHがGタンパク質を介した修飾作用を持つこと16)が知られている。したがって、GnRHは中枢神経系においてもニューロンの長期的興奮性上昇を引き起こしたり、シナプス終末からの伝達物質放出に対して影響を及ぼしたりする可能性があるといえよう。
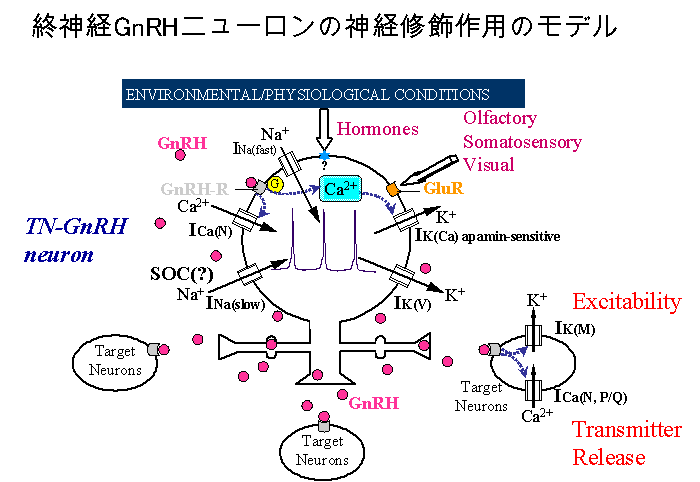
図3。終神経GnRH細胞の神経修飾機能に関するモデル。終神経GnRH細胞は,活動電位発生に関わる従来のナトリウムチャネルとは異る種のナトリウムチャネルINa(slow) とテトラエチルアンモニウム感受性カリウムチャネルIK(V)の相互作用により規則的なペースメーカー活動をしている。終神経GnRH細胞は神経終末や神経突起のバリコシティーおよび細胞体・樹状突起部など細胞の各部からGnRHペプチドを放出している。細胞体・樹状突起部から放出されたGnRHは自分自身もしくは隣接するGnRH細胞の活動を促進する(自己分泌,もしくは旁分泌)ことにより同期化したGnRHニューロン活動の正のフィードバック的促進を行っている。このとき,放出されたGnRHはGタンパク質共役型受容体(GnRH-R)に結合し,次のように働くと考えられる。 (1) GnRH受容体活性化は細胞内カルシウムストアからのカルシウム放出を促進し,これによりカルシウム依存性カリウムチャネルIK(Ca)が活性化する。これによりペースメーカー頻度は減少する。 (2)Gタンパク質活性化の下流の情報伝達系によるカルシウムチャネルICaの活性化,または,カルシウムストアの枯渇によって活性化される容量性カルシウム流入により,ペースメーカー活動の頻度が上昇する。これらのカルシウム流入はさらに,GnRHペプチドの開口放出の促進に働く。環境からの感覚情報入力やホルモン・フェロモン入力などが,これと類似のメカニズムでホルモンや伝達物質の受容体を介してGnRHニューロンに働きかけ,GnRHニューロンのイオンチャネルや細胞内情報伝達系を修飾することによりそのペースメーカー活動を修飾する。これによって脳の広い部位におけるGnRHニューロンからのGnRH放出も変化する。GnRHは標的ニューロン(GnRH受容体をもつニューロン)の興奮性に関わるカリウムチャネルや伝達物質放出に関わるカルシウムチャネルを修飾することにより,最終的には動物行動の動機づけや覚醒状態などの微妙な調整をすると考えられる。
終神経GnRH系の神経修飾作用は行動の動機付けに関与する?
これまで述べてきたように、終神経GnRH細胞の形態学的・電気生理学的特徴は次第に明らかになってきた。しかしながら、終神経GnRH系の神経修飾作用が動物個体レベルでどのような機能をもっているのか、という最初に掲げた素朴な疑問は、やはり依然として未解決のままである。そこで、こうした疑問の解決に一歩でも近づくために、我々は終神経GnRH細胞の局所的破壊を行って、オスの性行動に対する影響を調べてみた(これは大変骨の折れる実験で、当時大学院生の山本直之さんが3年以上かけて実験を行い、それからまた時間をかけてデータ解析し、ようやく実験から数年後に論文として発表することができた17))。終神経GnRH細胞を両側性に破壊すると、観察時間中にまったく巣作り行動を開始しない個体が増えた。ただし、他の性行動のレパートリーついては特に変化がなかった。また、巣作りについても、観察時間中にいったん行動を始めた個体については、単位時間あたりの行動の頻度は変わらなかった。この行動実験の結果は、終神経GnRH系は1)性行動レパートリーの一つである「巣作り行動」開始の閾値の制御に関わっている、言い換えると動機付けの強さを調節している、2)ただしこの行動の直接的制御には関わらないらしく、いったん行動がトリガーされるとそれ以降の機構には必須ではない、ということを示唆していた。脊椎動物における終神経GnRH系の破壊実験はこれ以外には報告が極めて少ないので終神経GnRH系の個体レベルでの機能に関しては未だ謎が多いが、おそらく、終神経GnRH系は性行動等の制御にとって必須というよりは、性行動の「動機付け」レベルの微妙な調節をしているのではないかと想像される。また、性行動だけでなく、動物の覚醒レベルの調節のようなことにも関わっているのかもしれない(科学的に表現しがたいので論文には書けないが、終神経GnRH細胞群を破壊した魚は何かボーッとしている印象がある;山本・小林私信)。最近、性行動の動機付けを定量的に評価できるような行動のパラメーターを発見したので、現在、動機付けに対するGnRHアゴニストやアンタゴニストの効果を調べる行動実験を始めている。
終神経GnRH細胞は開口放出によってGnRHを放出している
これまで述べてきたように、環境の変化は神経伝達物質やホルモンという形で神経系・内分泌系の信号を生じさせ、それが終神経GnRH細胞の細胞膜に存在する伝達物質・ホルモン受容体を活性化し、それと共役する細胞内情報伝達機構によって終神経GnRH細胞からのGnRH放出が調節される、という機構が考えられる。終神経GnRH細胞から分泌されるGnRHが、脳内の広い部位の標的ニューロンに一斉に何らかの神経修飾作用を及ぼしていると考えると、GnRHの分泌量を調節することによって、広範囲の神経系の機能を柔軟に変化させることが可能になるであろう。
このようなモデルを支持するためには、まず、GnRH放出をリアルタイムに測定しつつ、神経伝達物質やホルモンなどを作用させたときにGnRH放出がどう変化するかを知る必要がある。ところが、ペプチドホルモンの放出を測定するには、メディウム中に放出されるGnRHをRIAなどで測定するか、reverse
hemolytic plaque assayで個々の細胞からの放出を測定する、という方法しか従来はなかった。終神経GnRH細胞の活動とGnRH放出の関係を研究する上では、GnRH放出のリアルタイム測定が不可欠と考え、微小炭素線維電極(CFE)を用いた、単一細胞からの
GnRH放出の測定法を新たに開発した18)。これは、開口放出(エクソサイトーシス)によって放出されたGnRHが、細胞に密着したCFE上に吸着されて、特定の電圧において酸化還元反応を起こす時に生じる微小な電流を検出する電気化学的方法である。この方法を用いて、視索前野GnRH細胞の下垂体軸索終末や終神経GnRH細胞の細胞体からの開口放出によるGnRH放出のリアルタイム測定に成功した。先に電顕観察したときにも終神経GnRHニューロンの細胞体でGnRHの開口放出が起きる可能性を論文で指摘していた。ペプチド放出を電気化学的にリアルタイム測定した例は初めてであり、しかも、軸索終末だけではなくニューロンの細胞体からペプチド放出が起きるという現象を直接証明した例も初めてであろう。現在解析を進めているところなのでここではまだ詳しく述べられないが、ペプチド放出に関する新しい知見が多数得られそうな予感がしている(実に希望的観測!)。現段階ではまだ結論めいたことはいえないが、終神経GnRH細胞の通常のペースメーカー活動頻度ではGnRH放出量はあまり多くない可能性がある。すると、通常のペースメーカー活動時には、終神経GnRH細胞がGnRHと同時に産生していると予想されるペプチド以外の神経伝達物質によって通常のシナプス伝達が行われている可能性も考えられる。実際、最近我々は終神経GnRH細胞がGnRHと同時にグルタミン酸を神経伝達物質として用いている可能性を示唆するような形態学的データを得つつある(山本との共同研究)。この場合には、ペースメーカー活動によってシナプス後細胞に生じるであろう、規則的なシナプス入力が大事な情報を伝えている可能性も考えられる。一方、ある種のアゴニスト刺激によって細胞内情報伝達系を介する細胞内Ca2+濃度上昇がGnRH放出を引き起こしている可能性を示すようなデータも出始めており、これまでに述べてきたような作業仮説を支持できる実験的証拠が得られるかもしれないと期待している。この方向の実験を効率的に押し進めるために、さきほども少し触れたように、GnRHニューロンの解離細胞を作成するべく現在努力しているところである。それは、解離細胞を用いるとペプチド放出、細胞内Ca2+濃度、電気的活動、の3者を単一細胞で同時にリアルタイムに測定することが可能になるからである。ドワーフグーラミーの終神経GnRH細胞はこれまでに述べてきたように、大型で細胞塊を形成しているので、この部分だけを取り出して解離できるのではないかと期待している。
おわりに
文頭にも述べたように、この魚がペプチドニューロンを研究する上での実験動物として極めて有用であることは、偶然見つけたのであるが、自然の与えてくれた偶然の機会を自分が利用することができたことを感謝している。また、余談になるが、神経分泌の概念を最初に提唱したErnst
Scharrerは数種の魚類(ハヤの仲間)の脳においてコロイド滴をもった巨大な終神経ニューロンを記載しており、視索前野のニューロンとともに、これらのニューロンの観察が神経分泌の概念に結びついたとされている。この発見から約70年たって、この細胞をペプチドニューロンの神経修飾・分泌機能のモデル系として有用な実験系にすることができたことを大変嬉しく思う。最後になったが、この研究の遂行にあたって直接・間接にお世話になった、共著者の方も含めた多くの方々に謝辞を述べたい。未解決の問題が山積みになっているので、これからも多くの方々の手を借りて、どしどし新しい技術やアイデアを取り入れながら、素朴な疑問の解明に向かいたいと思っている。
引用文献
1) Oka, Y. (2002) Physiology and release activity of GnRH neurons.
Progress in Brain Research (in press)
2) 岡 良隆 (2002) 神経修飾物質としてのペプチドGnRH(生殖腺刺激ホルモン放出ホルモン)とその放出.魚類のニューロサイエンス(植松・岡・伊藤編)恒星社厚星閣pp.
160-177.
3) Oka, Y. and Abe, H. (2002) Physiology of GnRH neurons and
modulation of their activities by GnRH. In: "Neuroplasticity,
Development, and Steroid Hormone Action" (ed. by R.J. Handa,
S. Hayashi, E. Terasawa, and M. Kawata), CRC Press, Boca Raton,
pp. 191-203.
4) 岡 良隆 (1998) GnRHニューロンの形態学的・電気生理学的特徴.脳と生殖 GnRH神経系の進化と適応.学会出版センター.69-96.
5) Oka Y (1997) The gonadotropin-releasing hormone (GnRH) neuronal
system of fish brain as a model system for the study of peptidergic
neuromodulation. In: GnRH neurons: genes to behavior. (Parhar
IS, Sakuma Y Eds) Brain Shuppan Publishers, Tokyo, 245-276.
6) Demski LS, Northcutt RG (1983) The terminal nerve: A new chemosensory
system in vertebrates? Science 220: 435-437.
7) Oka, Y. and T. Matsushima (1993) Gonadotropin-releasing hormone
(GnRH)-immunoreactive terminal nerve cells have intrinsic rhythmicity
and project widely in the brain. J. Neurosci. 13: 2161-2176.
8) Oka, Y. (1995): Tetrodotoxin-resistant persistent Na+ current
underlying pacemaker potentials of fish gonadotrophin-releasing
hormone neurones. J. Physiol., 482, 1-6
9) Oka, Y. (1996): Characterization of TTX-resistant persistent
Na+ current underlying pacemaker potentials of fish gonadotropin-releasing
hormone (GnRH) neurons. J. Neurophysiol., 75, 2397-2404
10) Abe H, Oka Y (1999) Characterization of K+ currents underlying
pacemaker potentials of fish gonadotropin-releasing hormone cells.
J. Neurophysiol. 81: 643-653.
11) Abe, H. and Oka, Y. (2000) Modulation of pacemaker activity
by salmon gonadotropin-releasing hormone (sGnRH) in terminal
nerve (TN)-GnRH neurons. J. Neurophysiol. 83: 3196-3200.
12) Abe, H. and Oka, Y. (2002) Mechanisms of the modulation of
pacemaker activity by GnRH peptides in the terminal nerve-GnRH
neurons. Zool. Sci. 19: 111-128.
13) Yamamoto, N. and Ito, H. (2000) Afferent sources to the ganglion
of the terminal nerve in teleosts. J. Comp. Neurol., 428: 355-375
14) Parhar,I.S., T. Soga and Y. Sakuma (2000): Thyroid hormone
and estrogen regulate brain region-specific messenger ribonucleic
acids encoding three gonadotropin-releasing hormone genes in
sexually immature male fish, Oreochromis niloticus. Endocrinol.
141: 1618-1626.
15) Brown DA (1988) M-currents: an update. Trends Neurosci 11:
294-299
16) Elmslie KS, Zhou W, Jones SW (1990) LHRH and GTP-?-S modify
calcium current activation in bullfrog sympathetic neurons. Neuron.
5: 75-80
17) Yamamoto N, Oka Y, Kawashima, S (1997) Lesions of gonadotropin-releasing
hormone (GnRH)-immunoreactive terminal nerve cells: effects on
the reproductive behavior of male dwarf gouramis. Neuroendocrinolology
65: 403-412
18) Ishizaki, M., and Oka, Y. (2001) Amperometric recording of
gonadotropin-releasing hormone release activity in the pituitary
of the dwarf gourami (teleost) brain-pituitary slices. Neuroscience
Letters: 299: 121-124.