氏 名 筒井 秀和
近年、神経科学は分子・細胞、及び認知・高次機能を対象とした二つの大きな領域において著しい発展を遂げてきた。しかしながら脳機能は多数の神経細胞から構成される複雑な並列回路の上に実現されているはずであり、これら二つの領域の間を繋ぐであろう第三の領域における理解の進展をなくして神経組織の本質的な理解をすることは不可能であろうと考えられている。第三の領域とは即ち、神経回路がどのような機構でどのような機能を持つのかという問題に答えようとする分野である。この領域における本格的な実験的アプローチを阻んでいる主因は現在の測定技術では、同定された神経回路において多数の細胞の活動を高時空間分解能で測定することが極めて困難なことにある。
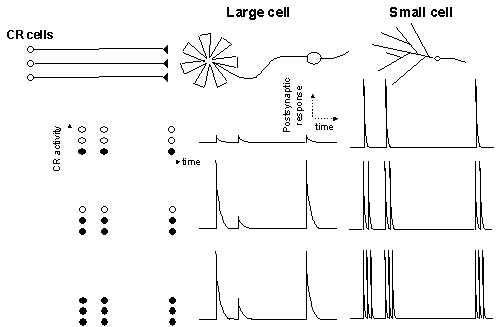
一方で、条鰭類に属する多くの魚類の視庄には糸球体核という神経核が存在する。糸球体核は主に視覚性の情報を受け視床下部下葉へと投射する機能的に興味深い神経核である(図)。さらにこの神経核は、1)構成細胞が2種と少ない(大型細胞、小型細胞)、2)解剖学的に明確な入出力線維を持つ、3)完全に層構造化している、4)大型細胞は巨大な樹状突起の先端を持つ、といった幾つかの際立った形態的な特徴を持つ(3,4
は一部の魚種)。これらの特徴的な形態から、糸球体核は神経回路の機能を構成要素を同定した上で調べるのに適しており、さらに将来的には上記における第三の領域に対する優れた実験系となりうる可能性もあると考えられるが、これまでその生理学的な特性は明らかにされてこなかった。そこで本研究では、糸球体核のin
vitro 実験系を開発し、主に電気生理的手法により構成細胞および入力核からのシナプス伝達の特性を調べ(第一部)、またその特性を担うと考えられる細胞膜上のNa+チャネルの性質を解析した(第二部)。さらに膜電位感受性色素を用いた光学的測定法により、入力繊維刺激に対する神経核活動の二次元イメージングを行った
(第三部)。
第一部 in vitro 実験系の開発、及び構成細胞およびシナプス伝達の特性の解析
実験は糸球体核において特に明確な層構造がみられる海産魚カワハギ(Stephanoplepis cirrhifer; 成体15-20
cm)を用いた。人工脳脊髄液は血清の電解質濃度を解析したものを基に作成し、使用した。脳を摘出後に低融点のAgaroseに抱埋したのちマイクロスライサーで糸球体核および入力繊維束を含む前頭断脳スライス標本を作成した。この方法で、標本作成後通常10時間以上実験に使用できた。
大型細胞樹状突起先端より微小電極による細胞内記録、大型細胞、小型細胞の細胞体よりパッチ電極によるwhole-cell記録を行った(current
clamp)。記録細胞の同定は、直接目視により可能であるが、記録電極からのbiocytinを用いた細胞内染色でも行った。またこれにより詳細な単一細胞の形態が観察できた。大型細胞の樹状突起先端は低い膜抵抗をもつ受動的な性質のみが観察された。次に入力繊維(皮質核繊維)を双極電極で刺激し、後シナプスの応答を解析した。その結果、大型細胞、小型細胞共に興奮性及び抑制性のシナプス入力を受けるが、これはAMPA受容体、NMDA受容体、GABAA受容体を介するものであることが薬理学的実験により明らかにされた。細胞体での応答の特性は両細胞で対照的であった。即ち大型細胞はシナプス入力に対して単発の発火のみを示し、小型細胞は入力依存的にtonicな発火を示した。この特性は電極からの定電流注入にたいする応答でも同様に見られた。さらに、時間間隔を変化させながらペアの入力を与え、入力の時間的な様式に対する応答を比較したところ、大型細胞が長い時定数(~100ms)のlow-passフィルター特性を持つのに対して、小型細胞は速い入力パターンにも追従して発火した。以上の結果から、大型細胞は皮質核活動の時間的な特徴をコードし、小型細胞は入力核活動の量をコードする特徴があると考えられた(下図)。

第二部 大型細胞細胞体におけるNa+チャネルの解析
大型細胞の細胞体におけるlow-passフィルター特性は細胞のどのような性質によるのであろうか?発火後に大型細胞の静止膜電位に特に変化は見られず、また定電流刺激によりる単発発火の特性はCa2+
freeの細胞外液でも同様であることからK+ やCa2+チャネルの関与の可能性は低いと考えられた。そこで活動電位の生成に直接関与するNa+チャネルの解析をvoltage
clamp下で行った。細胞外液にTEA(20mM)、Ni2+(1.5mM)を入れK+、Ca2+電流を阻害し、Na+電流を単離した。電極内液の主成分はKClもしくはCsClのものを使用した。これらの間で記録される電流に差は見られなかった。この状態で流れる電位依存性の電流はそべてTTX(0.5uM)で阻害されることから他の電流成分は残っていないと考えられた。さらに外液Na+濃度をcholine
chlorideで置換しfinal 72mM まで下げ、clampの向上を図った。保持電位-80mVから各電位(-110〜+30mV)にステップ状に電位を変えると、-50mV以上において活性化したNa+電流が記録された。まず、Na+電流がHodgkin-Huxleyモデルに従うかを記録された各電位における電流をmnh
のkineticsで最適なnをLevenberg-Marquardt algorithm で求めることにより検討した。その結果各電位に対してn=2.5〜3.4でよくfitした。したがって大型細胞のNa+電流は古典的なm3h
のモデルに従うと考えられた。次に記録された電流にm3hのkineticsをfitさせ、各電位におけるgNa, tm, thを求めた(ここでgNa
:コンダクタンスの最高値、tm, th:m, h gateの時定数)。-50mV以下の膜電位における tm に関しては '-80mV→0mVで電流をactivateさせたのち各電位に振り、そこでde-activationの時間依存性により測定した。th に関しては各電位でrecovery
from inactivationの時間依存性により測定した。その結果、大型細胞のNaチャネルは特に-80mV前後で極めて大きな th を持つこと明らかとなった(-80mvで>100ms)。さらにtm,
th、及びsteady-state activation, inactivation からm,hそれぞれのa ( forward
time constant ), b (backward time constant)を求め、これらをBoltzman関数、指数関数でfit及び連続化し、シュミレーションプログラムNEURON上でこのNa+チャネルの再構成をsingle
compartmentのもとで行った。その結果、このNa+チャネルと、古典的なHodgkin-Huxley型のK+チャネルの組み合わせのみで、大型細胞の基本的な単発発火特性及びlow-pass
filter特性が再現できた。同様の条件で小型細胞から記録されたNa+電流はより短い th を持つことが示唆され、このチャネルの特性の違いによりそれぞれの細胞の特性が形成されていると考えられた。今回解析された長い
th を持つNa+チャネルは、今後分子生物学的手法と組み合わせることで、新規チャネル遺伝子のクローニングさらに大型細胞の特異的マーカー及びプロモーターの探索へと発展する可能性を示すものである。
第三部 糸球体核活動の膜電位感受性色素を使った光学的測定
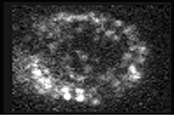
電位感受性色素を用いた神経細胞の活動の光学的測定は近年、神経活動の多点測定法の一つとして発展を遂げてきた。多点測定という従来の電気生理学的手法にはない利点を持つが、これまで単離細胞の実験系以外では、同定された細胞からの光学的シグナルを得ることが困難であるため、その適用範囲は限られてきた。糸球体核は明瞭な層状の細胞構築に加え、巨大な大型細胞のシナプス後樹上突起を含むため、他の標本では以前困難な、単一細胞の分解能で神経核の活動を捉えられる可能性があると考えた。脳スライスを膜電位感受性色素(Di-4-ANEPPS, 10uM)で染色し、532nmのレーザー光を励起光に用い、入力線維刺激に対する糸球体核全体の膜電位ダイナミクスを蛍光強度変化として測光した。測定系は高速で動作するCCD (90 x 60 pixels, 0.75ms/frame) を用いたシステムを使用した。刺激に対して大型細胞樹状突起層、及び小型細胞層から脱分極性のシグナルが測定された。このシグナルはAMPA受容体の阻害剤(NBQX)によって阻害されたのでシナプス後電位由来であると考えられる。小型細胞層からのシグナルは小型細胞由来であると考えられるが、シグナル強度は弱かった(dF/F~0.01%)。樹状突起層からのシグナルは強度が強く(df/F~0.1%)パッチ状に現れ(下図)、単一パッチの大きさは単一の大型細胞の樹状突起先端の大きさとほぼ同程度であり、その時間経過も電気生理学的に記録されたものとよく一致することから、単一細胞のシナプス後電位に由来するもと考えられた。
![]()