樹状突起モーターKIF17がNMDA受容体を目的地でおろす仕組み
(Guillaud L., Wong R., Hirokawa N. (2008). Disruption of KIF17-Mint1 interaction by CaMKII-dependent phosphorylation: a molecular model of Kinesin-cargo release. Nature Cell Biology 10, p.19-29)
NMDA受容体は神経細胞の後シナプスで他の神経細胞からの情報を受け取る働きを持っています。医学系研究科廣川らのグループは以前キネシンスーパーファミリータンパク質の一つKIF17がMint1というタンパク質を介して細胞体で合成されたNMDA受容体をシナプス後部まで輸送することを明らかにしました。一方、他の神経細胞から刺激を受けるとシナプス後部の細胞膜上のNMDA受容体の量が増える現象が知られています。つまり、神経細胞の刺激に応じてモータータンパク質KIF17からNMDA受容体がはずれて細胞膜上に出てくる必要があるはずですが、その分子機構は謎でした。今回、廣川らのグループはCaMキナーゼIIという酵素がKIF17尾部をリン酸化することを明らかにしました。リン酸化されたKIF17はNMDA受容体とKIF17の間を橋渡ししているMint-1からはずれます。CaMキナーゼIIは神経細胞の刺激によって活性化することがよく知られています。これらのことから、神経細胞が刺激を受けて活性化したCaMキナーゼIIがKIF17をリン酸化した結果、KIF17からNMDA受容体がはずれるのだと考えられます。
本GCOEプログラム事業推進担当者
医学系研究科細胞生物学解剖学教室教授 廣川信隆
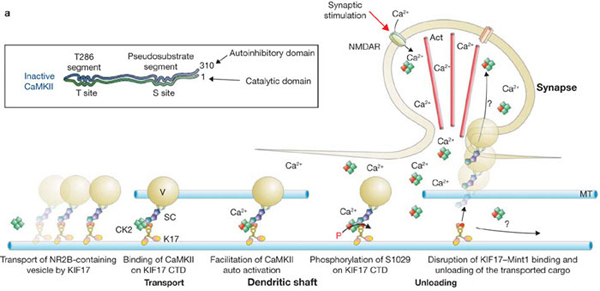
シナプスの刺激によって活性化したCaMKIIがKIF17をリン酸化してNMDA受容体を含む小胞がはずれる
Copyright (C) 2007-2009 All rights reserved tokyo-u.ac.jp
